서 론
산화질소(Nitric oxide, NO)는 높은 반응성의 무기유리기(free radical)로 인체에서 다양한 기관에서 중요한 생물학적 신호전달 역할을 하는 매개물질로 혈류 조절, 혈소판 기능, 신경신호전달, 면역, 염증 등에 관여하는 것으로 알려져 있다[1]. 산화질소는 L-arginine으로부터 산화질소 합성효소(NO synthase, NOS)에 의해 생성되고 조절되는데 NOS에는 3가지 종류(isoform)가 있다. 이 중 혈관내피세포에서 발현되는 내피형 NOS(endothelial NOS, eNOS, NOS-3)와 신경세포에서 발현되는 신경형 NOS(neuronal NOS, nNOS, NOS-1)는 구성형(constitutive form)으로 다른 자극 없이 지속적으로 NO를 생성하여 혈관내피세포의 평활근 이완, 신경 신호 전달 기능을 하며, 유도형 NOS(inducible NOS, iNOS, NOS-2)는 염증에 의해 활성화되어 NO를 생성하고 면역 방어 역할을 한다고 알려져 있다[2].
인간의 호흡에 NO가 존재하는 것을 발견하고 천식 환자에서 호기산화질소(exhaled NO, eNO)가 증가된 것이 알려지면서 이에 대한 많은 연구가 이루어져 왔고, 비강산화질소(nasal NO, nNO)도 최근 많은 연구가 되고 있다[3]. NO는 그 기원과 측정의 위치에 따라 2가지가 있는데 구강을 통해 내뿜는 공기를 채취하여 하기도 기원의 NO를 측정하는 호기산화질소(eNO)와 코를 통해 내뿜거나 흡입한 공기에서 비강과 부비동 기원의 NO를 측정하는 비강산화질소(nNO)가 있다. 특히 eNO는 주로 하기도의 과민성, 호산구성 염증, 아토피 등과 밀접한 연관이 있어, 천식 환자에서 염증 정도에 대한 비침습적 표지자로 임상에서도 진단과 치료 모니터링에 유용하게 사용되고 있다[4,5].
비강산화질소(nNO)는 다양한 생리적, 병리적 요인에 의해 영향을 받는데 그 중 염증 반응에 의해 크게 영향을 받기에 다양한 상기도의 염증성 질환에서 nNO의 역할에 대해 알아보고자 한다.
비강산화질소(nNO)
비강산화질소의 기원
정상 성인에서 nNO의 주 생성 장소가 비부비동인 것은 잘 알려져 있다[6]. 기관절개술을 한 환자에서 측정했을 때 90%이상의 NO는 비부비동에서 기원하는 것으로 증명되었고, 상악동 천자를 통해 매우 높은 농도(3,000~25,000 ppb)의 NO가 지속적으로 생성됨을 증명하였다[7]. 상기도에서는 3가지 NOS가 모두 발견되지만 NOS-2에 의해 고농도의 NO가 생성되는 것으로 알려져 있는데, NOS-2는 정상 부비동 상피에서는 발현이 높지만 비강 점막에는 발현이 적다[6-8]. 이를 토대로 비강에서 측정되는 대부분의 NO는 부비동에서 생성되어 나오는 것으로 볼 수 있다(Fig. 1).
흥미롭게도 부비동 내 정상 섬모상피세포 내의 NOS-2는 염증이 없는 정상 부비동 섬모상피세포에서도 지속적으로 NO를 생산하기에 유도형(inducible)과 구성형(constitutive)으로 NOS로 구분하는 것은 적절하지 않는 분류라는 의견도 있다[9].
비강산화질소의 역할
비강산화질소는 세균, 바이러스, 진균 감염에 대항하는 방어작용에 중요하게 작용한다고 알려져 있다. 일부 세균은 100 ppb NO에 의해 사멸되는데 부비동에는 고농도(3,000~25,000 ppb)로 존재하여 부비동을 무균환경으로 유지하는데 도움을 준다[10]. 또한 점액섬모운동을 증가시켜 점액섬모계 정화 운동을 향상시킴으로 방어 작용을 한다[11].
비강산화질소는 비저항을 조절하고 비강으로 들어온 공기의 가온, 가습 기능에도 관여할 것으로 여겨진다. 강력한 혈관확장 기능을 하는 NO는 수용혈관을 확장시켜 비저항을 조절하고, 혈관의 확장과 수축에 관여함으로 비강 내 온도를 조절하여 공기의 가온, 가습 기능을 한다[12].
비강산화질소는 들숨에 의해 폐로 흡인됨으로써 폐의 환기관류비(ventilation perfusion ratio)를 향상시키는 역할을 하는 것으로 알려져 있고 상기도와 하기도의 신호전달을 하는 체계(aerocrine messenger)로 여겨지고 있다[13].
비강산화질소와 상기도 염증성 질환
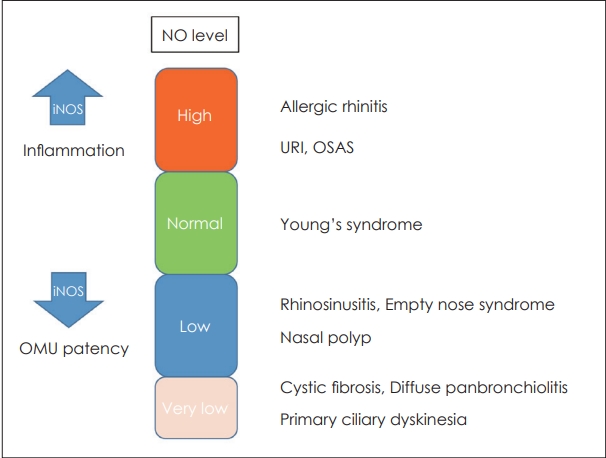
알레르기비염(Allergic rhinitis)
알레르기비염 환자의 비점막에는 높은 NOS-2의 발현을 보이고[8], 대부분의 알레르기비염 환자의 연구에서 nNO는 증가되는 것으로 알려져 있다(Fig. 2) [14-18]. 알레르기비염 환자의 비강세척액(nasal lavage fluid)에서 NO 대사산물인 아질산염(nitrite)과 질산염(nitrate)이 증가된 것도 이를 뒷받침해 준다[17]. nNO뿐 아니라 eNO도 같이 증가되었다는 연구결과가 더 많지만, nNO만 증가되었다는 연구결과도 적지 않다[15,16,18].
알레르기비염에서 nNO를 측정할 경우 유의할 사항이 있는데 부비동 질환을 받드시 배제해야 하고, 계절성인지 통년성인지 그리고 측정 시기가 꽃가루시즌인지 고려해야하고, 환자의 증상 유무나 심한 정도 등도 고려해야 한다. 알레르기비염의 중증도가 심할수록 nNO가 증가한다는 보고도 있지만[19,20] 중증도가 아주 심하면 비폐색이나 부비동 입구의 폐쇄로 인해 감소할 수 있다는 보고도 있다[17,21]. 이는 비폐색의 정도가 심할수록 nNO는 감소한다는 연구결과에서도 증명되었다[22].
치료에 있어서 국소 스테로이드 스프레이를 사용한 경우 nNO는 감소하고, 항히스타민제나 항류코트리엔 길항제는 nNO에 영향을 주지 않는 것으로 보고 되었다[15,19,23-26].
최근 나온 메타연구에서 nNO는 측정방법에 상관없이 알레르기 비염에서 높게 측정되며 천식, 비용종, 국소 스테로이드 스프레이, 흡연 등의 다른 요인에 의해 영향을 받지 않고 통년성, 계절성 알레르기비염에서 모두 적용된다고 하였고, 나이가 많고 폐기능이 좋은 사람일수록 정상인과 알레르기비염 환자의 nNO의 차이가 적다고 하였다[27].
비용종(Nasal polyp)
비용종 환자에서는 정상인보다 nNO가 낮게 측정되는 것으로 알려져 있다. 이렇게 낮아진 NO에 의해 코를 통해 들어온 상기도 바이러스나 세균에 대한 방어 역할을 하지 못해 비용을 가진 환자에서 잦은 상기도 감염 및 비부비동염이 발생한다고 추정한다[31].
비용종 조직에서 NOS-2의 발현은 증가되어 있어[32] 이론적으로는 비용종 환자에서 nNO는 증가되어야 하나 최근의 메타분석 연구를 포함하여 대부분의 연구에서 낮게 측정되는 것으로 보고된다[33]. 비록 비용종 조직에서는 NOS-2의 발현이 증가되어 있지만 동반된 만성 비부비동염이 있는 부비동 점막에는 NOS-2가 감소되어 있어 NO 생성이 감소할 수 있고, 비용종으로 인해 부비동개구연합(Ostiomeatal unit, OMU)의 폐쇄로 상악동에서 생성된 NO가 비강으로 배출되지 못하는 것도 nNO 감소의 주요 원인이다.
이런 사실은 CT와 내시경 점수 등 비용종의 심한 정도와 nNO의 관련성 연구에서 음의 상관관계가 있는 것으로 보고되고, 비용종에 대한 약물이나 수술적 치료에 의해 nNO가 증가되는 것이 밝혀지면서 더 명확하게 되었다[34-36]. 즉 치료로 부비동의 NOS-2의 발현이 정상화 되고, 비용종에서 국소 스테로이드 스프레이를 사용하면 비용종의 NOS-2의 발현은 저하되지만 비용종의 크기가 감소하여 상악동 자연공의 환기가 증가하여 상악동 NO의 배출이 증가하여 nNO가 증가한다[37]. 특히 수술적치료를 한 군에서 더 많이 증가되는 것으로 부비동 자연공의 개존도의 역할이 더 크다는 것을 보여 준다.
비부비동염(Rhinosinusitis)
산화질소는 세균의 증식을 억제하고 살균 효과로 병원균의 군체 형성이나 감염을 억제하는 역할을 하기에 부비동의 높은 농도의 NO는 비부비동을 질병과 감염으로부터 보호하는 기능을 하는 것으로 알려져 있다.
비용종을 동반하지 않은 급성 및 만성 비부비동염 모두에서 nNO는 감소하는 것으로 알려져 있다. 이는 상악동 부비동 점막 섬모상피세포의 NOS-2가 저하되어 NO 생성이 감소하는 것으로 알려져 있다[40,41]. 또한 이는 비부비동염의 치료 후에 nNO가 증가하는 것을 보여줌으로 더 명확히 하였다[42,43]. 하지만 비부비동염에서 nNO가 낮게 측정되는 것이 부비동에서 NO 생성이 감소되어서 생기는지, 비부비동염의 2차 변화인 국소 부종, 비강 울혈, 부비동 내 점액의 저류에 의해 부비동 자연공의 폐쇄로 배출이 안되어 생기는 지는 명확하지 않다.
일측성 비부비동염인 곰팡이성 부비동염, 일측성 비용종, 비부비동 종양, 치성부비동염 등에서 nNO를 비교한 연구에서는 병변측과 건측에서 측정한 값의 차이가 없고, 병변의 정도와 관련성이 없는 것으로 보고 되었다[44]. 이는 일측 부비동이 정상이면 정상 부비동에서 배출되는 NO가 후비공을 통해 동시에 측정되기 때문으로 생각된다.
원발섬모운동이상증(Primary ciliary dyskinesia, PCD)
원발섬모운동이상증에서 nNO는 아주 낮은 농도로 측정되어 선별검사로 사용되고 있다. 낭성섬유증(Cystic fibrosis, CF), 미만성 범세기관지염(diffuse panbronchiolitis)에서도 nNO는 아주 낮아질 수 있어 PCD의 확진 보다는 nNO가 정상이면 PCD를 제외할 수 있는 것으로 임상에서 사용되고 있다[45].
낭성섬유증(Cystic fibrosis, CF)
동양인에서는 드물고 서양인에 많은 낭성 섬유증은 cystic fibrosis transmembrane conductance regulator(CFTR) 유전자의 변이에 의해 기도점액 상피의 이상으로 잦은 호흡기 감염이 발생하고 부비동은 만성적으로 감염되어 있고 막히게 되는 질환이다.
미만성 범세기관지염(Diffuse panbronchiolitis)
원인불명의 세기관지의 염증, 기관지확장증, 반복적인 부비동염이 발생하는 것으로 만성 기도감염으로 점액섬모의 기능장애를 가져오는데 이 질환에서도 nNO가 감소하는것으로 보고되었다[51].
빈코증후군(Empty nose syndrome)
비갑개 조직의 과도한 소실로 증상이 발생하는 빈코증후군 환자에서 nNO가 감소되어 있고 점막하 보형물 삽입술 3개월 이후에 nNO가 증가되고, 심리적 증상의 호전과 상관관계가 있는 것으로 보고되었다[52]. 이에 빈코증후군 환자의 우울증, 불안장애 증상에도 nNO의 역할이 있을 것으로 추정하였다.
폐쇄성 수면무호흡증(Obstructive sleep apnea syndrome, OSAS)
폐쇄성 수면무호흡증에서 기도의 염증은 중요한 역할을 한다. 폐쇄성 수면무호흡증 환자에서 NO에 대한 연구결과는 다양하지만 최근의 메타분석 연구에 의하면 OSAS 환자에서 nNO가 증가하는 것으로 알려져 있는데, 특히 비흡연자에서 nNO는 무호흡저호흡지수(Apnea hypopnea index, AHI), 혈중 산소포화도와 양의 상관관계가 있는 것으로 보고하였다[53]. 또한 OSAS 환자의 비강에서 채취한 콧물에서 염증세포(neutrophil)와 cytokine(IL-6, 8)이 증가되어 있고 nNO와 상관관계가 있다는 것을 보고하여 OSAS 환자의 기도에는 염증이 존재하고 이로 인해 nNO가 증가한다고 하였다[54]. 폐쇄성 수면무호흡 환자에서 nNO뿐만 아니라 eNO도 정상인 보다 높고, 수면 전보다 수면 후가 더 높다고 보고 하였다[53].
폐쇄성 수면무호흡 환자에서 양압기 사용 전후로 nNO를 비교하였을 때 양압기 사용 후에 의미 있게 감소하는 것으로 알려져 있는데, eNO와 달리 nNO는 AHI와 연관성을 보일 정도로 관련이 있다고 하여 OSAS 환자에서 상기도는 반복적인 기도 폐쇄(collapse)에 의해 기도 점막에 염증이 증가하여 발생한다고 추정하였다[55].
소아 OSAS 환자에서도 nNO는 증가하였으나 중증도와는 관련성은 없었다는 보고도 있다[56].
산화질소 측정법(NO measurement methods)
생체시스템에서는 NO의 반감기는 매우 짧아서 과거 생체내 연구에서는 액화상태의 NO를 측정하였다. 또한 NO의 대사 산물인 nitrate와 nitrite를 측정하거나 NOS의 발현을 보는 면역조직화학염색이나 분자생물학적 방법인 PCR 등을 사용하여 간접적으로 측정하였다.
조직내의 NO와는 달리 기체 상태의 NO는 조금 더 안정적인데 기체상태의 eNO와 nNO의 측정법으로 과거에는 고정된 큰 크기의 장비를 사용하는 화학발광분석기(chemiluminescence analyzer, 예: NOA280iⓇ)이 주로 이용되었다[57,58]. 이는 기체 상태의 NO와 분석기에서 발생되는 오존 사이의 광화학(photochemical) 반응으로 측정한다. 최근에는 작은 크기의 이동식 전기화학분석기(electrochemical analyzer, 예: NIOX MinoⓇ, NIOX VeroⓇ, NObreathⓇ 등)를 연구뿐만 아니라 임상 클리닉에서도 활용하고 있다(Fig. 3) [59].
비강산화질소(nNO)의 측정법
측정법이 표준화 되어 있고 단순하고 재현성이 높은 eNO와는 달리 nNO의 측정법은 매우 까다롭고 고려해야할 사항이 많다. ATS-ERS에서도 eNO의 측정법은 표준화하여 권고하고 있지만 nNO에서는 하나의 표준화된 방법을 결론내지 못하였다[57,58].
가장 간단하고 흔히 사용되는 방법은 분석기의 내부 흡입력으로 비강으로부터 공기를 바로 흡입하여 측정하는 방법(aspiration method)이다[60]. 샘플링 호스를 올리브(nasal olive)나 캐뉼라에 연결하여 한쪽 비강에 대고 코 호흡을 멈춘 상태로 입천장(velum)을 막고 공기를 일정 속도로 흡인해서 분석하는 것이다. 다른 방법으로는 밀폐된 안면 마스크를 쓰고 일정한 속도로 코로 한번의 내쉼 호흡(breath exhalation)을 해서 측정하는 방법(exhalation method)이 있다[61]. 이때는 구강으로도 같은 속도로 측정해서 나중에 코에서 측정한 값에서 빼서 사용한다.
측정법과 관련된 일반적인 유의사항
이런 방법들은 환자의 협조가 안되어 측정이 어렵거나 날씨나 외기의 상태 등에 따라 보정이 필요할 때가 종종 있다[18]. 예를 들면 숨을 참거나 일정한 속도로 호흡을 내쉼 호흡이 안되는 유소아나 진정 상태의 환자에서는 불가능할 수도 있다.
모든 방법에서 코를 통한 호기(exhalation method) 또는 흡인(aspiration method)하는 속도가 일정해야 washout phase를 지나 일정한 NO plateau를 확립할 수 있다. 또한 기류의 속도가 달라지면 비강 내에서 다른 공기역학 패턴(예: laminar vs. turbulent flow)을 보이고 이는 nNO의 측정 결과에 영향을 미칠 수 있다[62]. 이런 이유로 어떤 표준화된 방법을 쓰더라도 반드시 코를 통한 기류의 속도를 엄격히 통제해야 한다.
한번의 내쉼호흡을 통한 측정법(exhalation method)에서 권고되는 호기 속도는 0.25~3 L/min 사이로 이 범위 내에서는 nNO가 비교적 일정한 것으로 알려져 있고 속도가 높을수록 NO는 증가될 수 있다[62]. 코를 통해 흡인한 공기를 측정하는 측정법(aspiration method)에서는 올리브나 카테터의 흡입속도는 50 mL/s로 일정하게 유지해야 하며 속도가 빠르면 nNO는 낮아지고 느리면 높게 측정된다[33]. 한쪽 비강이 열린 상태에서 반대측 코에서 흡입하여 측정하는 경우 nNO는 대기의 NO 값의 영향을 많이 받으므로 측정된 NO 값에서 대기중의 NO 값을 뺀 값을 보정하여 사용하기도 한다[18,34].
최근 국내에서 비급여로 임상진료시 사용하는 이동식 소형 측정기(handheld electrochemical analyzer)의 경우 eNO 측정에는 문제 없으나 장비에 적절한 기구를 끼워 일측에서 코로 호기를 하는 방식으로 nNO를 측정하는 것은 의미가 없다. 일정한 속도로 호기를 하기 어려워 재현성을 보이기 어렵고, 하기도의 공기가 혼합되어 순수한 비부비동의 NO라고 하기 어렵기 때문이다. 대신 일정한 속도로 흡입하는 nNO 측정용 이동식 측정기가 개발되고 있다[63].
허밍(Humming) 측정법
비부비동의 복잡한 구조로 인해 비강으로 측정한 NO는 그 기원이 부비동인지 비강점막인지 알 수 없다. 부비동의 높은 농도의 NO가 비강으로 나오면 비강점막으로부터 분비되는 NO의 작은 변화는 상쇄 시킬 수 있다. 따라서 개인내에서나 개인간에서 nNO 측정값은 많은 차이가 있을 수 있다.
Humming을 하면 부비동이 공명통으로 작용해 부비동과 비강의 빠른 가스 교환에 의해 nNO가 현저하게 증가하는 것으로 알려져 있다[64]. 또한 측정 전에 반복적으로 Humming을 하다 중지하고 측정하면 nNO는 감소하는 것으로 알려져 있다[65]. 이는 부비동에 축적되어 있던 NO가 빠르게 제거되어 일시적으로 비강에서 측정되는 NO 값에 부비동의 기여가 감소하는 것으로 설명된다. 이렇게 측정하면 부비동의 기여를 최소화하면서 좀 더 비점막 기원의 nNO를 측정하는데 도움이 될 수 있다는 것이다.
Humming 측정법은 OMU의 개존도를 테스트 하는 새로운 방법으로 사용할 수 있는데 Humming 동안 이런 nNO의 증가가 관찰되지 않는다면 양측 비용종이 있어 부비동 자연공이 막혀 있다고 생각할 수 있다. 또한 알레르기 비염 환자에서 Humming을 했을 때 점막부종으로 자연공이 폐쇄되어 있다면 peak가 없거나 감소될 수 있다[66].
비강산화질소를 이용한 연구의 제한점
측정법이 단순하고 재현성이 좋은 호기산화질소 측정과는 달리 비강산화질소는 측정법이 매우 까다로워 연구 및 임상에서 사용하기에 제한점이 많다. 측정법이 까다로워 소아나 협조가 잘 안되는 환자에서는 측정이 어려울 수 있고 날씨나 외기의 상태 등에 따라 측정값이 달라질 수 있다. 호기나 흡인하는 기류의 속도에 따라 측정값의 변동이 심하므로 코를 통한 기류의 속도를 엄격히 통제해야 하는 어려움이 있다. 또한 부비동의 높은 농도의 NO가 비강으로 나오면 비강점막으로부터 분비되는 NO의 작은 변화는 상쇄 시킬 수 있어 비강 질환의 경우 부비동의 상태에 따라 영향을 심하게 받을 수 있다.
결 론
비강산화질소는 국소적으로는 상기도의 방어작용을 할뿐만 아니라 원격으로는 폐기능을 조절하는 신호전달물질의 역할을 하는 것으로 알려져 있는데, 상기도의 다양한 생리적, 병리적 인자에 의해 영향을 받을 수 있다. 또한 다양한 기도 질환에서 하기도에서 기원하는 eNO와 비부비동 기원의 nNO의 연관성을 보여 줌으로 상, 하기도는 ‘하나의 기도, 하나의 질환(One airway, one disease)”의 개념을 확인하는 근거가 되고 있다.
향후 연구에서 다양한 상기도 염증성 질환에서 nNO의 작용기전을 더 밝히고, nNO에 영향을 주는 요소들을 더 이해하여 nNO의 측정방법이 표준화되어 재현성 높은 정상 수치가 확립된다면, 다양한 상기도 질환을 더 간단하고 빠르게 진단하는 방법으로 사용되고 치료 모니터링에 더 유용하게 활용될 것으로 생각된다.





 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print